Nykyaikaisen lääketieteen alalla antibiootit ovat osoittautuneet yhdeksi merkittävimmistä edistysaskeleista, sillä ne ovat vähentäneet dramaattisesti mikrobi-infektioiden ilmaantuvuutta ja kuolleisuutta. Niiden kyky muuttaa bakteeri-infektioiden kliinisiä tuloksia on pidentänyt lukemattomien potilaiden elinajanodotetta. Antibiootit ovat ratkaisevan tärkeitä monimutkaisissa lääketieteellisissä toimenpiteissä, kuten leikkauksissa, implanttien asennuksissa, elinsiirroissa ja kemoterapiassa. Antibiooteille vastustuskykyisten patogeenien ilmaantuminen on kuitenkin ollut kasvava huolenaihe, ja se on vähentänyt näiden lääkkeiden tehoa ajan myötä. Antibioottiresistenssiä on dokumentoitu kaikissa antibioottikategorioissa mikrobien mutaatioiden tapahtuessa. Mikrobilääkkeiden aiheuttama valintapaine on osaltaan johtanut resistenttien kantojen nousuun, mikä on merkittävä haaste maailmanlaajuiselle terveydelle.
Mikrobilääkeresistenssin polttavan ongelman torjumiseksi on tärkeää toteuttaa tehokkaita infektioiden torjuntatoimia, jotka hillitsevät resistenttien patogeenien leviämistä ja vähentävät antibioottien käyttöä. Lisäksi vaihtoehtoisille hoitomenetelmille on kiireellinen tarve. Hyperbaarinen happihoito (HBOT) on noussut lupaavaksi hoitomuodoksi tässä yhteydessä, ja siinä hengittää 100 % happea tietyillä painetasoilla tietyn ajanjakson ajan. Joko ensisijaisena tai täydentävänä hoitona infektioihin HBOT voi tarjota uutta toivoa antibiooteille vastustuskykyisten patogeenien aiheuttamien akuuttien infektioiden hoidossa.
Tätä hoitoa käytetään yhä enemmän ensisijaisena tai vaihtoehtoisena hoitona erilaisiin sairauksiin, kuten tulehduksiin, hiilimonoksidimyrkytyksiin, kroonisiin haavoihin, iskeemisiin sairauksiin ja infektioihin. HBOT:n kliiniset sovellukset infektioiden hoidossa ovat merkittäviä, ja ne tarjoavat potilaille korvaamattomia etuja.

Hyperbaarisen happihoidon kliiniset sovellukset infektioissa
Nykyiset todisteet tukevat vankasti HBOT:n käyttöä sekä itsenäisenä hoitona että lisähoitona, ja niistä on merkittäviä hyötyjä infektoituneille potilaille. HBOT:n aikana valtimoveren happipaine voi nousta 2000 mmHg:iin, ja siitä johtuva korkea happi-kudospainegradientti voi nostaa kudoksen happipitoisuudet 500 mmHg:iin. Tällaiset vaikutukset ovat erityisen arvokkaita iskeemisissä ympäristöissä havaittujen tulehdusvasteiden ja mikrokiertohäiriöiden paranemisen edistämisessä sekä osasto-oireyhtymän hallinnassa.
HBOT voi vaikuttaa myös immuunijärjestelmästä riippuvaisiin tiloihin. Tutkimukset osoittavat, että HBOT voi tukahduttaa autoimmuunioireyhtymiä ja antigeenien aiheuttamia immuunivasteita, auttaen ylläpitämään siirteen sietokykyä vähentämällä lymfosyyttien ja leukosyyttien verenkiertoa ja samalla moduloimalla immuunivasteita. Lisäksi HBOTtukee paranemistakroonisissa ihovaurioissa stimuloimalla angiogeneesiä, joka on kriittinen prosessi parannetulle toipumiselle. Tämä hoito edistää myös kollageenimatriisin muodostumista, joka on olennainen vaihe haavan paranemisessa.
Erityistä huomiota on kiinnitettävä tiettyihin infektioihin, erityisesti syviin ja vaikeasti hoidettaviin infektioihin, kuten nekrotisoivaan faskiittiin, osteomyeliittiin, kroonisiin pehmytkudosinfektioihin ja tarttuvaan endokardiittiin. Yksi HBOT:n yleisimmistä kliinisistä sovelluksista on iho-pehmytkudosinfektiot ja osteomyeliitti, joihin liittyy alhaisia happitasoja ja jotka johtuvat usein anaerobisista tai resistenteistä bakteereista.
1. Diabeettisen jalkatulehdukset
Diabeettisen jalanHaavaumat ovat yleinen komplikaatio diabeetikoilla ja ne vaikuttavat jopa 25 prosenttiin tästä väestöstä. Näissä haavaumissa esiintyy usein infektioita (40–80 % tapauksista), jotka johtavat lisääntyneeseen sairastuvuuteen ja kuolleisuuteen. Diabeetikkojen jalkainfektiot (DFI) koostuvat yleensä polymikrobi-infektioista, joissa on tunnistettu useita anaerobisia bakteeripatogeenejä. Useat tekijät, kuten fibroblastien toimintahäiriöt, kollageenin muodostumisongelmat, solujen immuunimekanismit ja fagosyyttien toiminta, voivat haitata haavan paranemista diabeetikoilla. Useat tutkimukset ovat tunnistaneet heikentyneen ihon hapettumisen voimakkaaksi riskitekijäksi DFI:hin liittyville amputaatioille.
Yhtenä nykyisistä DFI-hoidon vaihtoehdoistaHBOT-hoidon on raportoitu parantavan merkittävästi diabeettisten jalkahaavojen paranemisnopeutta, mikä vähentää amputaatioiden ja monimutkaisten kirurgisten toimenpiteiden tarvetta. Se ei ainoastaan minimoi resursseja vaativien toimenpiteiden, kuten läppäleikkausten ja ihonsiirron, tarvetta, vaan myös tarjoaa alhaisemmat kustannukset ja minimoi sivuvaikutukset kirurgisiin vaihtoehtoihin verrattuna. Chenin ym. tutkimus osoitti, että yli 10 HBOT-hoitokertaa johti 78,3 %:n parannukseen diabeetikkojen haavan paranemisnopeudessa.
2. Nekrotisoivat pehmytkudosinfektiot
Nekrotisoivat pehmytkudosinfektiot (NSTI) ovat usein polymikrobisia, tyypillisesti aerobisten ja anaerobisten bakteeripatogeenien yhdistelmästä johtuvia ja niihin liittyy usein kaasuntuotantoa. Vaikka NSTI:t ovat suhteellisen harvinaisia, niiden kuolleisuusaste on korkea nopean etenemisensä vuoksi. Oikea-aikainen ja asianmukainen diagnoosi ja hoito ovat avainasemassa suotuisten tulosten saavuttamisessa, ja HBOT:ta on suositeltu lisämenetelmäksi NSTI:iden hoidossa. Vaikka HBOT:n käytöstä NSTI:issä on edelleen kiistaa prospektiivisten kontrolloitujen tutkimusten puutteen vuoksi,todisteet viittaavat siihen, että se saattaa korreloida NSTI-potilaiden parantuneiden eloonjäämisasteiden ja elinten säilymisen kanssaRetrospektiivinen tutkimus osoitti merkittävää kuolleisuuden vähenemistä HBOT-hoitoa saavilla NSTI-potilailla.
1.3 Leikkausalueen infektiot
Leikkausalueen infektiot voidaan luokitella infektion anatomisen sijainnin perusteella, ja ne voivat johtua useista taudinaiheuttajista, mukaan lukien sekä aerobiset että anaerobiset bakteerit. Huolimatta infektioiden torjuntatoimenpiteiden edistyksistä, kuten sterilointitekniikoista, profylaktisten antibioottien käytöstä ja kirurgisten käytäntöjen parannuksista, leikkausalueen infektiot ovat edelleen pysyvä komplikaatio.
Yhdessä merkittävässä katsauksessa on tutkittu HBOT:n tehokkuutta syvien leikkausalueinfektioiden ehkäisyssä neuromuskulaarisessa skolioosileikkauksessa. Leikkausta edeltävä HBOT voi vähentää merkittävästi leikkausalueinfektioiden ilmaantuvuutta ja edistää haavan paranemista. Tämä ei-invasiivinen hoito luo ympäristön, jossa haavakudoksen happitasot ovat koholla, mikä on yhdistetty oksidatiiviseen taudinaiheuttajien tappamiseen. Lisäksi se puuttuu alentuneisiin veren ja hapen tasoihin, jotka edistävät leikkausalueinfektioiden kehittymistä. Muiden infektioiden torjuntastrategioiden lisäksi HBOT:ta on suositeltu erityisesti puhtaisiin, kontaminoituneisiin leikkauksiin, kuten kolorektaalisiin toimenpiteisiin.
1.4 Palovammat
Palovammat ovat äärimmäisen kuumuuden, sähkövirran, kemikaalien tai säteilyn aiheuttamia vammoja, ja ne voivat aiheuttaa korkean sairastuvuuden ja kuolleisuuden. HBOT on hyödyllinen palovammojen hoidossa lisäämällä vaurioituneiden kudosten happipitoisuuksia. Vaikka eläin- ja kliiniset tutkimukset ovat antaneet vaihtelevia tuloksia...HBOT:n tehokkuus palovammojen hoidossaTutkimuksessa, johon osallistui 125 palovammapotilasta, havaittiin, että HBOT-hoidolla ei ollut merkittävää vaikutusta kuolleisuuteen tai suoritettujen leikkausten määrään, mutta se lyhensi keskimääräistä paranemisaikaa (19,7 päivää verrattuna 43,8 päivään). HBOT-hoidon yhdistäminen kattavaan palovammojen hoitoon voisi tehokkaasti hallita sepsistä palovammapotilailla, mikä johtaisi lyhyempiin paranemisaikoihin ja vähentyneeseen nestetarpeeseen. HBOT-hoidon roolin vahvistamiseksi laajojen palovammojen hoidossa tarvitaan kuitenkin lisää laajoja prospektiivisia tutkimuksia.
1.5 Osteomyeliitti
Osteomyeliitti on luun tai luuytimen infektio, jonka usein aiheuttavat bakteeripatogeenit. Osteomyeliitin hoito voi olla haastavaa luiden suhteellisen heikon verenkierron ja antibioottien rajallisen tunkeutumisen vuoksi luuytimeen. Krooniselle osteomyeliitille ovat ominaisia pysyvät patogeenit, lievä tulehdus ja nekroottinen luukudoksen muodostuminen. Refraktaarinen osteomyeliitti viittaa kroonisiin luuinfektioihin, jotka jatkuvat tai uusiutuvat asianmukaisesta hoidosta huolimatta.
HBOT:n on osoitettu parantavan merkittävästi infektoituneen luukudoksen happitasoja. Lukuisat tapaussarjat ja kohorttitutkimukset osoittavat, että HBOT parantaa osteomyeliittipotilaiden kliinisiä tuloksia. Se näyttää toimivan useiden mekanismien kautta, mukaan lukien aineenvaihdunnan tehostaminen, bakteeripatogeenien tukahduttaminen, antibioottien vaikutusten tehostaminen, tulehduksen minimointi ja paranemisen edistäminen.prosesseja. HBOT-hoidon jälkeen 60–85 prosentilla kroonista, refraktaarista osteomyeliittiä sairastavista potilaista ilmenee infektion heikkenemisen merkkejä.
1.6 Sieni-infektiot
Maailmanlaajuisesti yli kolme miljoonaa ihmistä kärsii kroonisista tai invasiivisista sieni-infektioista, jotka johtavat vuosittain yli 600 000 kuolemaan. Sieni-infektioiden hoitotulokset heikentyvät usein sellaisten tekijöiden vuoksi kuin muuttunut immuunijärjestelmä, perussairaudet ja patogeenien virulenssiominaisuudet. HBOT on tulossa houkutteleva hoitovaihtoehto vakavissa sieni-infektioissa turvallisuuden ja ei-invasiivisen luonteensa ansiosta. Tutkimukset osoittavat, että HBOT voisi olla tehokas sienitauteja, kuten Aspergillus- ja Mycobacterium tuberculosis -sieniä, vastaan.
HBOT edistää sienilääkkeiden vaikutuksia estämällä Aspergilluksen biofilmin muodostumista, ja tehokkuuden on havaittu lisääntyneen kannoissa, joilta puuttuu superoksididismutaasi (SOD) -geeni. Sieni-infektioiden aikana vallitsevat hypoksiset olosuhteet asettavat haasteita sienilääkkeiden annostelulle, minkä vuoksi HBOT:n lisäämät happitasot ovat mahdollisesti hyödyllinen interventio, vaikka lisätutkimuksia tarvitaankin.
HBOT:n antimikrobiset ominaisuudet
HBOT:n luoma hyperoksinen ympäristö käynnistää fysiologisia ja biokemiallisia muutoksia, jotka stimuloivat antibakteerisia ominaisuuksia, mikä tekee siitä tehokkaan lisähoidon infektioihin. HBOT:lla on merkittäviä vaikutuksia aerobisiin bakteereihin ja pääasiassa anaerobisiin bakteereihin sellaisten mekanismien kautta kuin suora bakterisidinen vaikutus, immuunivasteiden tehostuminen ja synergistiset vaikutukset tiettyjen mikrobilääkkeiden kanssa.
2.1 HBOT:n suorat antibakteeriset vaikutukset
HBOT:n suora antibakteerinen vaikutus johtuu suurelta osin reaktiivisten happilajien (ROS) muodostumisesta, joihin kuuluvat superoksidianionit, vetyperoksidi, hydroksyyliradikaalit ja hydroksyyli-ionit – jotka kaikki syntyvät solujen aineenvaihdunnan aikana.
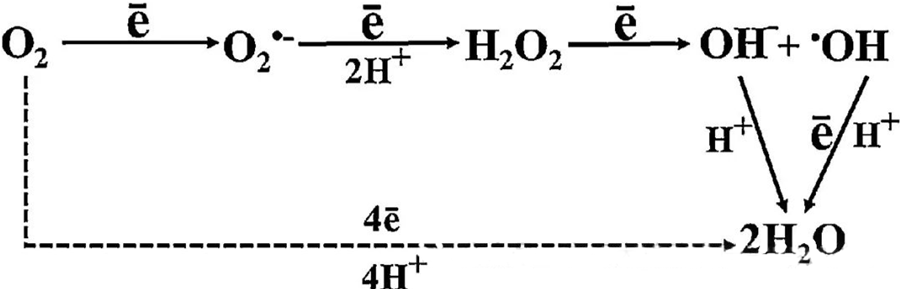
O₂:n ja solukomponenttien välinen vuorovaikutus on olennaista solujen ROS-muodostumisen ymmärtämiseksi. Tietyissä olosuhteissa, joita kutsutaan oksidatiiviseksi stressiksi, ROS-muodostumisen ja sen hajoamisen välinen tasapaino häiriintyy, mikä johtaa ROS-pitoisuuksien nousuun soluissa. Superoksidin (O₂⁻) tuotantoa katalysoi superoksididismutaasi, joka sitten muuntaa O₂⁻:n vetyperoksidiksi (H₂O₂). Tätä muuntumista vahvistaa edelleen Fentonin reaktio, joka hapettaa Fe²⁺:n muodostaen hydroksyyliradikaaleja (·OH) ja Fe³⁺:a, mikä käynnistää haitallisen ROS-muodostumisen ja soluvaurioiden redox-sekvenssin.
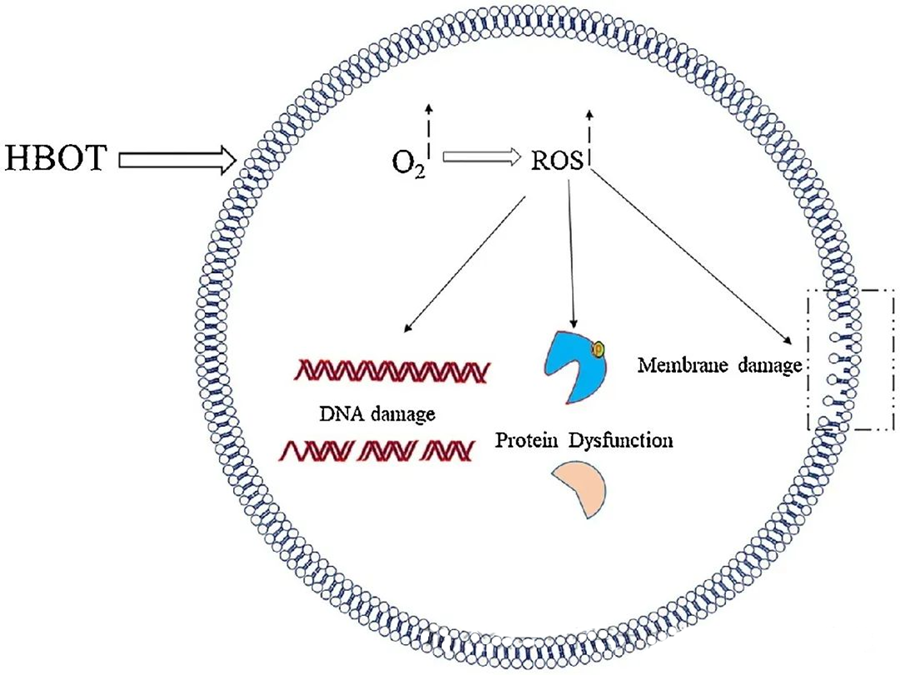
ROS:n myrkylliset vaikutukset kohdistuvat kriittisiin solukomponentteihin, kuten DNA:han, RNA:han, proteiineihin ja lipideihin. Erityisesti DNA on H₂O₂:n välittämän sytotoksisuuden ensisijainen kohde, koska se häiritsee deoksiriboosirakenteita ja vahingoittaa emäskoostumuksia. ROS:n aiheuttama fyysinen vaurio ulottuu DNA:n helix-rakenteeseen, ja se voi johtua ROS:n laukaisemasta lipidiperoksidaatiosta. Tämä korostaa kohonneiden ROS-tasojen haitallisia seurauksia biologisissa järjestelmissä.
ROS:n antimikrobinen vaikutus
ROS-yhdisteillä on keskeinen rooli mikrobien kasvun estämisessä, kuten HBOT:n indusoima ROS-yhdisteiden muodostuminen osoittaa. ROS-yhdisteiden myrkylliset vaikutukset kohdistuvat suoraan solun osiin, kuten DNA:han, proteiineihin ja lipideihin. Suuret aktiivisten happilajien pitoisuudet voivat vahingoittaa lipidejä suoraan, mikä johtaa lipidiperoksidaatioon. Tämä prosessi vaarantaa solukalvojen eheyden ja siten kalvoihin liittyvien reseptorien ja proteiinien toimivuuden.
Lisäksi proteiinit, jotka ovat myös merkittäviä ROS:n molekyylikohteita, läpikäyvät spesifisiä oksidatiivisia modifikaatioita eri aminohappotähteissä, kuten kysteiinissä, metioniinissa, tyrosiinissa, fenyylialaniinissa ja tryptofaanissa. Esimerkiksi HBOT:n on osoitettu indusoivan oksidatiivisia muutoksia useissa E. coli -proteiinissa, mukaan lukien elongaatiotekijä G ja DnaK, ja vaikuttavan siten niiden solutoimintoihin.
Immuniteetin parantaminen HBOT:n avulla
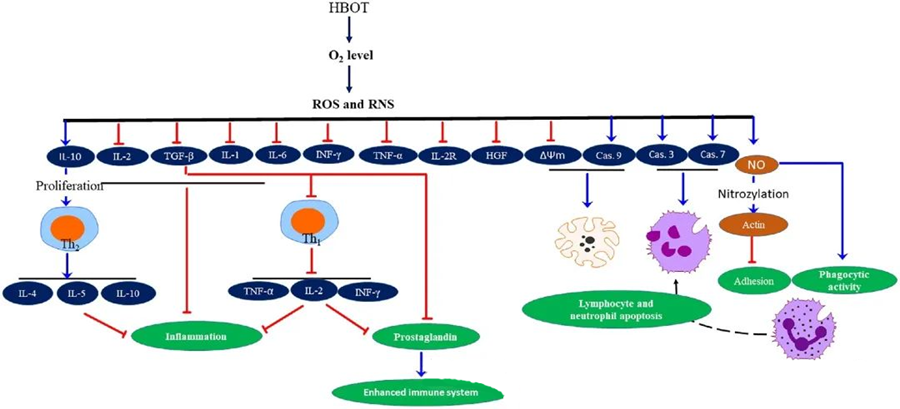
HBOT:n tulehdusta estävät ominaisuudeton dokumentoitu, ja niiden on osoitettu olevan ratkaisevan tärkeitä kudosvaurioiden lievittämisessä ja infektion etenemisen estämisessä. HBOT vaikuttaa merkittävästi sytokiinien ja muiden tulehdusta säätelevien aineiden ilmentymiseen, mikä puolestaan vaikuttaa immuunivasteeseen. Useat kokeelliset järjestelmät havaitsivat erilaisia muutoksia geenien ilmentymisessä ja proteiinien muodostumisessa HBOT:n jälkeen, jolloin kasvutekijöiden ja sytokiinien ilmentymistä joko lisääntyy tai vähenee.
HBOT-prosessin aikana kohonneet O₂-tasot laukaisevat erilaisia soluvasteita, kuten estävät tulehdusta edistävien välittäjäaineiden vapautumista ja edistävät lymfosyyttien ja neutrofiilien apoptoosia. Yhdessä nämä toiminnot tehostavat immuunijärjestelmän antimikrobisia mekanismeja, mikä helpottaa infektioiden paranemista.
Lisäksi tutkimukset viittaavat siihen, että kohonneet O₂-tasot HBOT:n aikana voivat vähentää tulehdusta edistävien sytokiinien, kuten interferoni-gamman (IFN-γ), interleukiini-1:n (IL-1) ja interleukiini-6:n (IL-6), ilmentymistä. Näihin muutoksiin kuuluu myös CD4:CD8 T-solujen suhteen lasku ja muiden liukoisten reseptorien modulointi, mikä lopulta nostaa interleukiini-10 (IL-10) -tasoja, mikä on ratkaisevan tärkeää tulehduksen torjumiseksi ja paranemisen edistämiseksi.
HBOT:n antimikrobiset vaikutukset ovat kietoutuneet monimutkaisiin biologisiin mekanismeihin. Sekä superoksidin että kohonneen paineen on raportoitu edistävän epäjohdonmukaisesti HBOT:n aiheuttamaa antibakteerista aktiivisuutta ja neutrofiilien apoptoosia. HBOT:n jälkeen merkittävä happitasojen nousu tehostaa neutrofiilien bakterisidista kykyä, joka on olennainen osa immuunivastetta. Lisäksi HBOT estää neutrofiilien adheesiota, jota välittää neutrofiilien pinnalla olevien β-integriinien vuorovaikutus endoteelisolujen solujen välisten adheesiomolekyylien (ICAM) kanssa. HBOT estää neutrofiilien β-2-integriinin (Mac-1, CD11b/CD18) aktiivisuutta typpioksidin (NO) välittämän prosessin kautta, mikä edistää neutrofiilien kulkeutumista infektiokohtaan.
Sytoskeletonin tarkka uudelleenjärjestäytyminen on välttämätöntä, jotta neutrofiilit voivat tehokkaasti fagosytoida taudinaiheuttajia. Aktiinin S-nitrosylaation on osoitettu stimuloivan aktiinin polymeroitumista, mikä voi helpottaa neutrofiilien fagosyyttistä aktiivisuutta HBOT-esikäsittelyn jälkeen. Lisäksi HBOT edistää apoptoosia ihmisen T-solulinjoissa mitokondrioiden kautta, ja lymfosyyttien kuoleman on raportoitu kiihtyneen HBOT:n jälkeen. Kaspaasi-9:n estäminen – vaikuttamatta kaspaasi-8:aan – on osoittanut HBOT:n immunomodulatoriset vaikutukset.
HBOT:n ja antimikrobisten aineiden synergistiset vaikutukset
Kliinisissä sovelluksissa HBOT:ta käytetään usein antibioottien rinnalla infektioiden tehokkaaseen torjuntaan. HBOT:n aikana saavutettava hyperoksinen tila voi vaikuttaa tiettyjen antibioottien tehoon. Tutkimukset viittaavat siihen, että tietyt bakterisidiset lääkkeet, kuten beetalaktaamit, fluorokinolonit ja aminoglykosidit, eivät vaikuta ainoastaan omien mekanismiensa kautta, vaan ne ovat osittain riippuvaisia bakteerien aerobisesta aineenvaihdunnasta. Siksi hapen läsnäolo ja patogeenien metaboliset ominaisuudet ovat keskeisiä antibioottien terapeuttisten vaikutusten arvioinnissa.
Merkittäviä todisteita on osoitettu, että alhaiset happitasot voivat lisätä Pseudomonas aeruginosan resistenssiä piperasilliinille/tatsobaktaamille ja että alhainen happiympäristö myötävaikuttaa myös Enterobacter cloacaen lisääntyneeseen resistenssiin atsitromysiinille. Toisaalta tietyt hypoksiset olosuhteet voivat lisätä bakteerien herkkyyttä tetrasykliiniantibiooteille. HBOT toimii käyttökelpoisena lisähoitomenetelmänä indusoimalla aerobista aineenvaihduntaa ja hapettamalla hypoksisisesti infektoituneita kudoksia, mikä lisää patogeenien herkkyyttä antibiooteille.
Prekliinisissä tutkimuksissa HBOT:n yhdistelmä – annettuna kahdesti päivässä 8 tunnin ajan 280 kPa:n paineessa – ja tobramysiini (20 mg/kg/vrk) vähensivät merkittävästi bakteerikuormaa Staphylococcus aureus -infektiollisessa endokardiitissa. Tämä osoittaa HBOT:n potentiaalin lisähoitona. Lisätutkimukset ovat osoittaneet, että 37 °C:ssa ja 3 ATA-paineessa 5 tunnin ajan HBOT tehosti merkittävästi imipeneemin vaikutuksia makrofagien infektoimia Pseudomonas aeruginosa -bakteereja vastaan. Lisäksi HBOT:n ja kefasoliinin yhdistelmähoidon havaittiin olevan tehokkaampi Staphylococcus aureus -osteomyeliitin hoidossa eläinmalleissa verrattuna pelkkään kefasoliiniin.
HBOT lisää myös merkittävästi siprofloksasiinin bakterisidista vaikutusta Pseudomonas aeruginosa -biofilmejä vastaan, erityisesti 90 minuutin altistuksen jälkeen. Tämä tehostuminen johtuu endogeenisten reaktiivisten happilajien (ROS) muodostumisesta ja osoittaa lisääntynyttä herkkyyttä peroksidaasidefekteillä mutanteilla.
Metisilliiniresistentin Staphylococcus aureuksen (MRSA) aiheuttaman pleuriitin malleissa vankomysiinin, teikoplaniinin ja linetsolidin yhteisvaikutus HBOT:n kanssa osoitti merkittävästi lisääntynyttä tehoa MRSA:ta vastaan. Metronidatsoli, antibiootti, jota käytetään laajasti vakavien anaerobisten ja polymikrobisten infektioiden, kuten diabeettisten jalkainfektioiden (DFI) ja leikkausalueen infektioiden (SSI), hoidossa, on osoittanut parempaa antimikrobista tehoa anaerobisissa olosuhteissa. Tulevia tutkimuksia tarvitaan HBOT:n ja metronidatsolin yhdistelmän synergististen antibakteeristen vaikutusten selvittämiseksi sekä in vivo että in vitro -olosuhteissa.
HBOT:n antimikrobinen teho resistentteihin bakteereihin
Resistenttien kantojen kehittymisen ja leviämisen myötä perinteiset antibiootit menettävät usein tehonsa ajan myötä. Lisäksi HBOT voi osoittautua olennaiseksi moniresistenttien patogeenien aiheuttamien infektioiden hoidossa ja ehkäisyssä, ja se voi toimia kriittisenä strategiana, kun antibioottihoidot epäonnistuvat. Lukuisat tutkimukset ovat raportoineet HBOT:n merkittävistä bakterisidisista vaikutuksista kliinisesti merkittäviin resistentteihin bakteereihin. Esimerkiksi 90 minuutin HBOT-hoito 2 ATM:n teholla vähensi merkittävästi MRSA:n kasvua. Lisäksi ratio-malleissa HBOT on tehostanut useiden antibioottien antibakteerisia vaikutuksia MRSA-infektioita vastaan. Raportit ovat vahvistaneet, että HBOT on tehokas OXA-48:aa tuottavan Klebsiella pneumoniaen aiheuttaman osteomyeliitin hoidossa ilman, että tarvitaan muita antibiootteja.
Yhteenvetona voidaan todeta, että hyperbaarinen happihoito edustaa monipuolista lähestymistapaa infektioiden torjuntaan, sillä se tehostaa immuunivastetta ja samalla vahvistaa olemassa olevien mikrobilääkkeiden tehoa. Kattavan tutkimuksen ja kehityksen avulla sillä on potentiaalia lieventää antibioottiresistenssin vaikutuksia, mikä tarjoaa toivoa meneillään olevassa taistelussa bakteeri-infektioita vastaan.
Julkaisuaika: 28. helmikuuta 2025

